Obesidad, inflamación e inmunidad ¿qué relación hay?
 CONCEPCIÓN Mª AGUILERA GARCÍA
CONCEPCIÓN Mª AGUILERA GARCÍA
Instituto de Nutrición y Tecnología de los Alimentos “José Mataix Verdú”
Departamento de Bioquímica y Biología Molecular II
Centro de Investigación Biomédica. Universidad de Granada
Instituto de Investigación Biosanitaria de Granada (ibs.GRANADA)
Centro de Investigación Biomédica en Red-Fisiopatología de la Obesidad y Nutrición (CIBEROBN)
Según la Organización Mundial de la Salud (OMS), la obesidad y el sobrepeso han alcanzado caracteres de epidemia a nivel mundial1. Más de mil millones de personas adultas tienen sobrepeso y, de ellas, al menos 300 millones son obesas. La preocupación por la prevalencia que la obesidad está adquiriendo a nivel mundial se debe a su asociación con las principales enfermedades crónicas de nuestro tiempo, como las enfermedades cardiovasculares, diabetes mellitus tipo 2, hipertensión arterial y ciertos tipos de cáncer. A mayor obesidad, mayores cifras de morbilidad y mortalidad por estas enfermedades. Además, los especialistas han recordado que el sobrepeso ya no es solo un factor de riesgo para otras enfermedades, sino que las cifras han demostrado que los pacientes con COVID-19 y sobrepeso han tenido un peor pronóstico. El 80% de los pacientes que tuvieron formas graves de la infección por COVID-19, que precisaron intubación, ventilación mecánica en la UVI y/o fallecieron eran obesos, según un estudio de meta-análisis recientemente publicado2.
En España la situación no es menos preocupante. Según el informe de la OCDE “The heavy burden of obesity”3, es uno de los países con mayores cifras de obesidad con una prevalencia del 61.6% de sobrepeso y obesidad en mayores de 15 años. Pero la situación es aún más alarmante en la población infantil entre 6 y 9 años, dónde según el último informe del estudio ALADINO 2019 presentado por la Agencia Española de Seguridad Alimentaria y Nutrición (AESAN)4, la prevalencia de sobrepeso es del 23,3 %, y la de obesidad alcanza el 17,3 %, según los estándares de situación ponderal de la OMS, es decir, cuatro de cada diez escolares tienen exceso de peso.
Los pacientes obesos presentan un estado inflamatorio crónico de bajo grado
La obesidad es una enfermedad causada por una acumulación excesiva de grasa en el tejido adiposo, que provoca un aumento del volumen del adipocito (hipertrofia), número de estos (hiperplasia), o bien, una combinación de ambos (hipertrofia-hiperplasia). El aumento en el tamaño del adipocito requiere de mayor cantidad de oxígeno, lo cual ocasiona hipoxia y pierde la capacidad de almacenar triglicéridos, lo que propicia la liberación de ácidos grasos que pueden llegar a acumularse en otros órganos, como el hígado y el músculo generando así un fenómeno de resistencia a la acción de la insulina con el consecuente aumento de la glucemia en sangre. A la remodelación del tejido adiposo por hipertrofia e hiperplasia de adipocitos se suma la remodelación vascular y de la matriz extracelular5. Dichas alteraciones del tejido adiposo desencadenan la liberación de moléculas conocidas como adipoquinas que son pequeñas hormonas secretadas por el adipocito, que participan en la homeostasis del organismo, y pueden tener propiedades inflamatorias o antiinflamatorias. La pérdida del equilibrio entre ambos tipos de adipoquinas se observa frecuentemente en estados como la obesidad, propiciando que el ambiente que rodea al adipocito fomente el inicio de procesos inflamatorios y de estrés oxidativo6,7.
La activación del sistema inmunitario permite el desarrollo de la inflamación del tejido adiposo en la obesidad
Las células que caracterizan el tejido adiposo son lógicamente los adipocitos, que son células grandes especializadas en la acumulación de lípidos. Sin embargo, actualmente se sabe que, si bien los adipocitos son los que ocupan prácticamente todo el tamaño del tejido, no son el único tipo celular presente y posiblemente tampoco el más abundante. Se ha descrito que aproximadamente el 80% de las células del tejido adiposo blanco de humanos no son adipocitos maduros sino que corresponden a células del estroma vascular entre las que se encuentran preadipocitos, células inmunitarias, células madre y células endoteliales.
Durante el desarrollo de la obesidad, las adipoquinas secretadas por el tejido adiposo, como la leptina, la resistina y la adiponectina, cambian gradualmente el equilibrio de las células del sistema inmunitario, de antiinflamatorio a proinflamatorio. Muchos tipos de células del sistema inmunitario innato están involucradas en el desarrollo de la inflamación del tejido adiposo. Las más estudiadas son los macrófagos que pueden tener diferentes funciones dependiendo de los estímulos ambientales. Estos pueden actuar de forma dual, o bien favoreciendo los procesos inflamatorios –macrófagos de tipo M1– o bien facilitando un ambiente anti-inflamatorio y reparador, encargados de desactivar los procesos inflamatorios mediante un proceso conocido como resolución de la inflamación, que son los de tipo M2. El balance entre estos dos tipos de macrófagos (M1 y M2) es esencial para un correcto funcionamiento del sistema inmunitario ya que la inflamación es una respuesta de defensa del organismo, pero cuando persiste es perjudicial.
En el tejido adiposo sano, los macrófagos M2 se distribuyen ampliamente y tienen efectos antiinflamatorios. Durante el desarrollo de la obesidad, aumenta la producción de moléculas que permiten la transmigración, adhesión e infiltración de monocitos sanguíneos en el tejido adiposo donde encontrarán un microambiente favorable para que se diferencien y se establezcan como macrófagos maduros. Este proceso lleva a que la presencia de macrófagos sea minoritaria, de un 5% en el tejido adiposo sano, mientras que puede llegar a representar el 50% en el obeso8. A diferencia de los macrófagos M2, los de tipo M1 producen mediadores proinflamatorios como las interleuquinas9. Estos mediadores inducen aún más la muerte de los adipocitos y regulan negativamente la síntesis adipocitaria. Estudios en los que se provoca una disminución de macrófagos M1 en animales obesos se observa una disminución de marcadores inflamatorios a nivel sistémico, a la vez que se normaliza la sensibilidad a la insulina10. Así pues, vemos que la presencia de macrófagos M1 y la incapacidad de su activación por la vía alternativa juegan un papel importante en el mantenimiento de la inflamación y en el establecimiento de la resistencia a la insulina y la obesidad.
Además de la acumulación de macrófagos del sistema inmunitario innato, numerosos estudios han demostrado que la obesidad también se asocia a una activación del sistema inmunitario adaptativo. Por ejemplo, se ha descrito una mayor infiltración de linfocitos T en el tejido adiposo durante la obesidad, aumentando la proporción de células T de tipo CD3+, CD4 + y CD8 +11,12. Junto a las células T, otras células, como son las células B juegan un papel importante en la transición de la homeostasis metabólica en el tejido adiposo sano a un estado de inflamación crónica y de resistencia a la insulina en personas con obesidad13. (Figura 1)
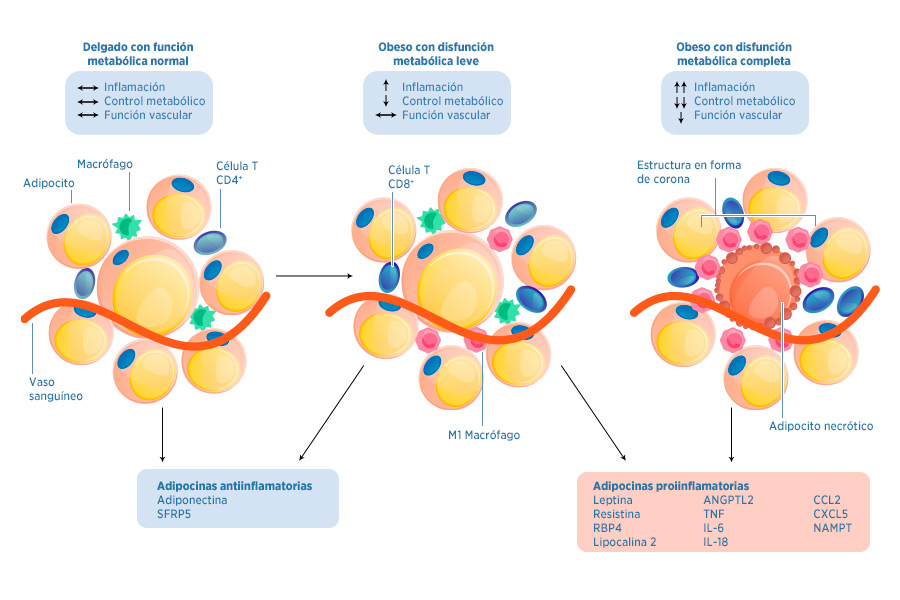
Figura 1. Diferencias funcionales y secrección de citoquinas entre individuos normales,
obesos con función metabólica comprometida y obesos con disfunción metabólica.
Fuente: Adaptado de Ouchi et al. Nat Review 2011
La inflamación es causante de resistencia a la insulina, de la enfermedad cardiovascular y del síndrome metabólico
El proceso inflamatorio crónico de baja intensidad presente en la obesidad, es el desencadenante de la resistencia a la insulina. Esta resistencia juega un papel crítico en la fisiopatología del Síndrome Metabólico, pudiéndose considerar a la obesidad visceral, como el principal detonante de ambos. La resistencia a la insulina se define clínicamente por la incompetencia de una concentración determinada de insulina (endógena o exógena) para incrementar la utilización celular de glucosa. Por tanto, a idéntica cantidad de insulina en sangre, menor retirada de glucosa circulante y peor rendimiento celular como combustible metabólico en los órganos diana (tejido adiposo, muscular y hepático, especialmente). Por otro lado, el Síndrome Metabólico es una entidad clínica que se caracteriza por un conjunto de factores de riesgo que incluyen obesidad visceral, alteraciones en el metabolismo de lípidos (aumento de triglicéridos y disminución de HDL-C) y de la insulina, hipertensión y presencia de factores protrombóticos e inflamatorios. En distintos estudios realizados tanto en niños como en adultos, se ha observado una correlación positiva entre Índice de Masa Corporal (IMC, usado para el diagnóstico de la obesidad y que corresponde al peso en Kg/altura en m2) y la presencia de síndrome metabólico14. Es necesario destacar que dentro de nuestro grupo de investigación hemos descrito un alto porcentaje de niños españoles obesos entre 6 y 12 años con Síndrome Metabólico, que presentan hipertensión arterial, resistencia a la insulina, biomarcadores séricos proinflamatorios y de riesgo cardiovascular15,16,17,18. (Figura 2)
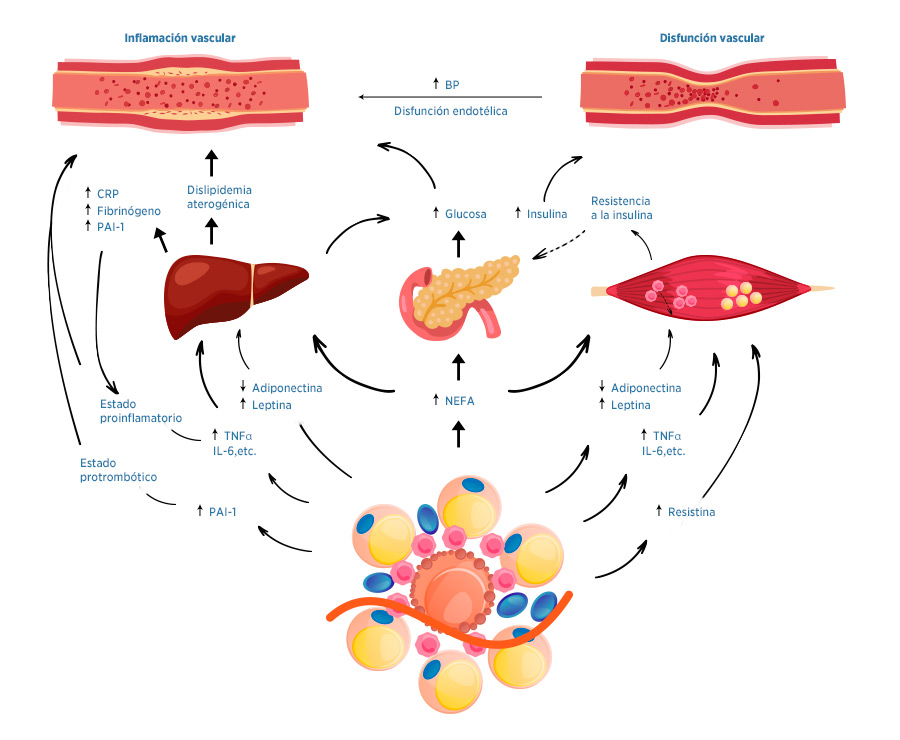
Figura 2. Alteraciones metabólicas en obesidad y consecuencias a nivel vascular.
Fuente: Adaptado de Cañete R, Gil-Campos M, Aguilera CM, Gil A. Eur J Nutr 2007
Los mediadores proinflamatorios generados en el tejido adiposo actúan de una manera autocrina, paracrina o endocrina, promoviendo la resistencia a la insulina por interferir con la señalización de la misma a través de la activación de vías celulares en las que participa el factor nuclear kappa B (NF-kB) a nivel local (tejido adiposo y macrófagos). Este último, un factor de trascripción inducible, activa la respuesta inmunitaria e inflamatoria, produciendo un gran número de citoquinas proinflamatorias y suprimiendo otras antinflamatorias5. Estos mediadores escapan a la circulación alcanzando a tejidos diana de la insulina (músculo esquelético e hígado), propiciando la resistencia a la insulina sistémica y reduciendo el efecto de la insulina en estos órganos, proceso clave que precede al desarrollo de enfermedades metabólicas. Además, se ha propuesto que el estrés oxidativo puede ser relevante en el inicio de la inflamación en la obesidad19. El incremento en la captura de glucosa por las células endoteliales del tejido adiposo en condiciones de hiperglucemia causa un exceso de especies reactivas de oxígeno en las mitocondrias, lo cual condiciona daño oxidativo y activa señales de inflamación dentro de la célula endotelial. El daño endotelial en el tejido adiposo causa quimiotaxis de macrófagos y exacerba aún más la inflamación local. En este sentido en nuestro grupo de investigación hemos descrito recientemente la alteración del sistema de defensa antioxidante en niños prepúberes obesos acompañado de mayores concentraciones séricas y en orina de productos de oxidación, además de los de inflamación antes descritos20.
La dieta y determinados nutrientes pueden modular el estado inflamatorio
La dieta puede influir la expresión y la secreción de biomarcadores en diferentes tejidos, lo que afecta al estado inflamatorio. En ese sentido, seguir una dieta ajustada en calorías, moderada en hidratos de carbono, abundante en ácidos grasos oleico y omega-3 y pobre en ácidos grasos saturados y trans, así como un consumo abundante de frutas y legumbres y moderado de alcohol, parece tener un efecto beneficioso en el estado inflamatorio relacionado con la obesidad y las manifestaciones del síndrome metabólico. Todavía queda por dilucidar el efecto a largo plazo de la ingesta dietética y los mecanismos involucrados en distintos estados fisiológicos y patológicos.
De entre los ácidos grasos monoinsaturados (AGMI), el ácido oleico es el principal componente, y el aceite de oliva y las nueces son importantes fuentes de este ácido graso, principalmente en la dieta mediterránea. La sustitución de la grasa saturada por AGMI tiene efecto beneficioso en el perfil lipídico, con una reducción de las concentraciones de cLDL y triglicéridos, manteniendo altas las concentraciones de cHDL, y tiene un importante papel en la prevención de la arteriosclerosis. Estudios observacionales han descrito una asociación inversa de la ingesta de aceite de oliva con la ganancia de peso en individuos sanos y con la expresión de mediadores inflamatorios, así como con el desarrollo de aterosclerosis, en individuos con alto riesgo de enfermedad cardiovascular. El estudio PREDIMED, desarrollado por investigadores españoles, ha conseguido demostrar el beneficio de la dieta mediterránea, destacando el consumo de aceite de oliva y nueces y su asociación con una menor muerte por infarto de miocardio acompañada por una reducción de biomarcadores inflamatorios21,22.
Por otro lado, numerosos estudios han demostrado un papel preventivo de los ácidos grasos poliinsaturados (AGPI) en el estado inflamatorio y en el desarrollo de problemas cardiovasculares. Entre ellos destacan los ácidos grasos omega-3 (alfalinolénico [ALA], eicosapentanoico [EPA], docosahexaenoico [DHA]) y los ácidos grasos omega-6 (linoleico [LA]), ambos nutrientes esenciales. EPA y DHA se encuentran preferentemente en los pescados y sus aceites, mientras que el ALA, un precursor de esos dos, tiene como fuentes los aceites de canola, soja y linaza y las nueces. En un metaanálisis de 14 estudios clínicos aleatorizados, 25 estudios prospectivos de cohorte y 7 de casos y controles, la ingesta de omega-3 procedente de pescados y aceite de pescado se asoció inversamente a la mortalidad súbita o por enfermedad cardiovascular23.
Conclusiones
· La obesidad es una enfermedad causada por una acumulación excesiva de grasa en el tejido adiposo que genera procesos inflamatorios y estrés oxidativo, lo cual agrava el desarrollo de otras enfermedades asociadas como la diabetes, alteraciones cardiovasculares y el cáncer.
· Las adipoquinas son hormonas secretadas por el tejido adiposo y se consideran mediadoras de la respuesta inflamatoria en la obesidad.
· El tejido adiposo, además de adipocitos, contiene otras células del estroma vascular como preadipocitos, células inmunitarias, células madre y células endoteliales.
· Tanto macrófagos como linfocitos, células del sistema inmunitario, presentes en el tejido adiposo participan en la inflamación crónica de bajo grado desencadenada por la obesidad.
· La inflamación iniciada en el tejido adiposo es la causante de resistencia a la insulina, de la enfermedad cardiovascular y del síndrome metabólico.
· Incrementar el consumo de grasas saludables (omega-3, oleico) y alimentos ricos en antioxidantes (frutas y verduras) es importante en enfermedades acompañadas por procesos inflamatorios.
Bibliografía
1. Organización Mundial de la Salud. https://www.who.int/es/news-room/fact-sheets/detail/obesity-and-overweight
2. Zhao X, Gang X, He G, Li Z, Lv Y, Han Q, Wang G. Obesity Increases the Severity and Mortality of Influenza and COVID-19: A Systematic Review and Meta-Analysis.Front Endocrinol (Lausanne). 2020 Dec 21;11:595109.
3. The Heavy Burden of Obesity | READ online. OECD iLibrary Available at: https://read.oecdilibrary.org/social-issues-migration-health/the-heavy-burden-of-obesity_67450d67-en
4. Estudio ALADINO 2019: Estudio sobre Alimentación, Actividad Física, Desarrollo Infantil y Obesidad en España 2019. Agencia Española de Seguridad Alimentaria y Nutrición. Ministerio de Consumo. Madrid, 2020. https://www.aesan.gob.es/AECOSAN/docs/documentos/nutricion/observatorio/Informe_Aladino_2019.pdf
5. Hotamisligil GS. Inflammation, metaflammation and immunometabolic disorders. Nature. 2017;542:177-185.
6. Arner P, Bernard S, Salehpour M, Possnert G, Liebl J, Steier P, Buchholz BA, Eriksson M, Arner E, Hauner H, Skurk T, Rydén M, Frayn KN, Spalding KL. Dynamics of human adipose lipid turnover in health and metabolic disease. Nature 2011; 478:110–113.
7. Ouchi N, Parker JL, Lugus JJ, Walsh K. Adipokines in inflammation and metabolic disease. Nat Rev Immunol. 2011;11:85-97.
8. Christiansen T, Richelsen B, Bruun JM. Monocyte chemoattractant protein-1 is produced in isolated adipocytes, associated with adiposity and reduced after weight loss in morbid obese subjects. Int J Obes Relat Metab Disord. 2004; 29: 146-150
9. Wu D, Molofaky AB, Liang HE, Ricardo-Gonzalez RR, Jouihan HA, Bando JK, et al. Eosinophils sustain adipose alternatively activated macrophages associated with glucose homeostasis. Science. 2011;332:243-247.
10. Patsouris D, Li PP, Thapar D, Chapman J, Olefsky JM, Neels JG. Ablation of CD11c-positive cells normalizes insulin sensitivity in obese insulin resistant animals. Cell Metab 2008; 8: 301-309.
11. Wu H, Ghosh S, Perrard XD, Feng L, Garcia GE, Perrard JL, et al. T-cell accumulation and regulated on activation, normal T cell expressed and secreted upregulation in adipose tissue in obesity. Circulation. 2007; 115: 1029-1038.
12. Kintscher U, Hartge M, Hess K, Foryst-Ludwig A, Clemenz M, Wabitsch M, et al. T-lymphocyte infiltration in visceral adipose tissue: A primary event in adipose tissue inflammation and the development of obesity-mediated insulin resistance. Arterioscler Thromb Vasc Biol. 2008; 28: 1304-1310.
13. Winer DA, Winer S, Shen L, Wadia PP, Yantha J, Paltser G, Tsui H, Wu P, et al. B cells promote insulin resistance through modulation of T cells and production of pathogenic IgG antibodies. Nat Med. 2011;17:610-617.
14. Esser N, Legrand-Poels S, Piette J, Scheen A, Paquot N. Inflammation as a link between obesity, metabolic syndrome and type 2 diabetes. Diabetes Res Clin Pract 2014; 105: 141-150.
15. Cañete R, Gil-Campos M, Aguilera CM, Gil A. Development of insulin resistance and its relation to diet in the obese child. Eur J Nutr. 2007; 46:181-187.
16. Rupérez AI, Olza J, Gil-Campos M, Leis R, Bueno G, Aguilera CM, Gil A, Moreno LA Cardiovascular risk biomarkers and metabolically unhealthy status in prepubertal children: Comparison of definitions. .Nutr Metab Cardiovasc Dis. 2018;28: 524-530
17. Olza J, Aguilera CM, Gil-Campos M, Leis R, Bueno G, Valle M, Cañete R, Tojo R, Moreno LA, Gil A. Waist-to-height ratio, inflammation and CVD risk in obese children. Public Health Nutr. 2014; 17:2378-85
18. Olza J, Aguilera CM, Gil-Campos M, Leis R, Bueno G, Valle M, Cañete R, Tojo R, Moreno LA, Gil Á. A Continuous Metabolic Syndrome Score Is Associated with Specific Biomarkers of Inflammation and CVD Risk in Prepubertal Children. Ann Nutr Metab. 2015;66:72-9.
19. Rupérez AI, Gil A, Aguilera CM. Genetics of oxidative stress in obesity. Int J Mol Sci. 2014;15:3118-3144.
20. Rupérez AI, Mesa MD, Anguita-Ruiz A, González-Gil EM, Vázquez-Cobela R, Moreno LA, Gil Á, Gil-Campos M, Leis R, Bueno G, Aguilera CM. Antioxidants and Oxidative Stress in Children: Influence of Puberty and Metabolically Unhealthy Status. .Antioxidants. 2020 ;9:618.
21. Garcia-Arellano A, Martínez-González MA, Ramallal R, Salas-Salvadó et al; SUN and PREDIMED Study Investigators. Dietary inflammatory index and all-cause mortality in large cohorts: The SUN and PREDIMED studies. Clin Nutr. 2019;38:1221-1231
22. Cantero I, Abete I, Babio N, Arós F, Corella D, Estruch R, Fitó M et al. Dietary Inflammatory Index and liver status in subjects with different adiposity levels within the PREDIMED trial. A J Clin Nutr. 2018;37:1736-1743.
23. Wang C, Harris WS, Chung M, Lichtenstein AH, Balk EM, Kupelnick, et al.n-3 Fatty acids from fish or fish-oil supplements, but not alpha-linolenic acid, benefit cardiovascular disease outcomes in primary- and secondary-prevention studies: a systematic review. Am J Clin Nutr 2006; 84: 5-17.